Résumé
- Définition et épidémiologie : Kienböck est une ostéonécrose avasculaire du lunatum, pathologie rare (prévalence ~7/100 000) touchant préférentiellement les hommes de 20–40 ans. L’étiologie reste inconnue et multifactorielles (facteurs anatomiques, vasculaires et environnementaux)**.
- Diagnostic : Les symptômes typiques sont douleur dorsale du poignet, tuméfaction et perte de force/mobilité**. Le diagnostic repose sur la radiographie standard (phases de Lichtman) complétées par l’IRM et l’arthroscopie pour évaluer la viabilité osseuse et l’état cartilagineux**. De nouvelles techniques d’imagerie (IRM de perfusion, CT haut-résolution) aident à déterminer si le lunatum est récupérable**.
- Traitement : En phase précoce (Lichtman I–IIA), la prise en charge initiale est conservatrice (immobilisation, arrêt des activités à risque), notamment chez l’enfant ou le sujet âgé qui réagissent bien sans chirurgie**. Si la douleur persiste, on privilégie un traitement spécifique selon la variance ulnaire et le stade radiologique**. Par exemple, une ostéotomie de raccourcissement radial est indiquée en cas de variance ulnaire négative*, alors qu’une ostéotomie du capitatum (ou fermeture de coin radial) peut être préférée pour variance neutre/positive**. L’arthroscopie du poignet a introduit des techniques mini‑invasives (forage arthroscopique du lunatum) qui donnent de bons résultats fonctionnels (amélioration de la mobilité, douleurs) pour les stades précoces**.
- Stades avancés et interventions complexes : Lorsque l’effondrement osseux progresse (Lichtman IIIb–IV) et que le cartilage lunatum est détruit, on se tourne vers des procédures de contournement : arthrodèses partielles (scaphocapitale, scapho‑trapézo-trapézoïdienne, radioscapho-lunaire) ou interventions de sauvetage comme la PRC ou l’arthroplastie/arthrodèse totale du poignet**. Des greffes osseuses pédiculées (pisiforme ou carpe vacant) sont aussi utilisées pour révasculariser et reconstruire le lunatum**. De plus, de nouvelles approches comme la prothèse costochondrale assistée par impression 3D montrent des résultats prometteurs en stade terminal**.
- Formation des chirurgiens : La prise en charge de Kienböck implique une formation dédiée. La simulation arthroscopique en réalité virtuelle améliore les compétences techniques et suscite l’intérêt des internes pour l’orthopédie**. Il est essentiel d’enseigner la mesure précise de la variance ulnaire, la classification de Lichtman (modifiée) et la classification arthroscopique (Bain) pour guider le traitement. L’utilisation de nouvelles technologies pédagogiques (simulateurs VR, modèles anatomiques 3D, imagerie de haute résolution) fait désormais partie de la formation pratique des internes.
Introduction
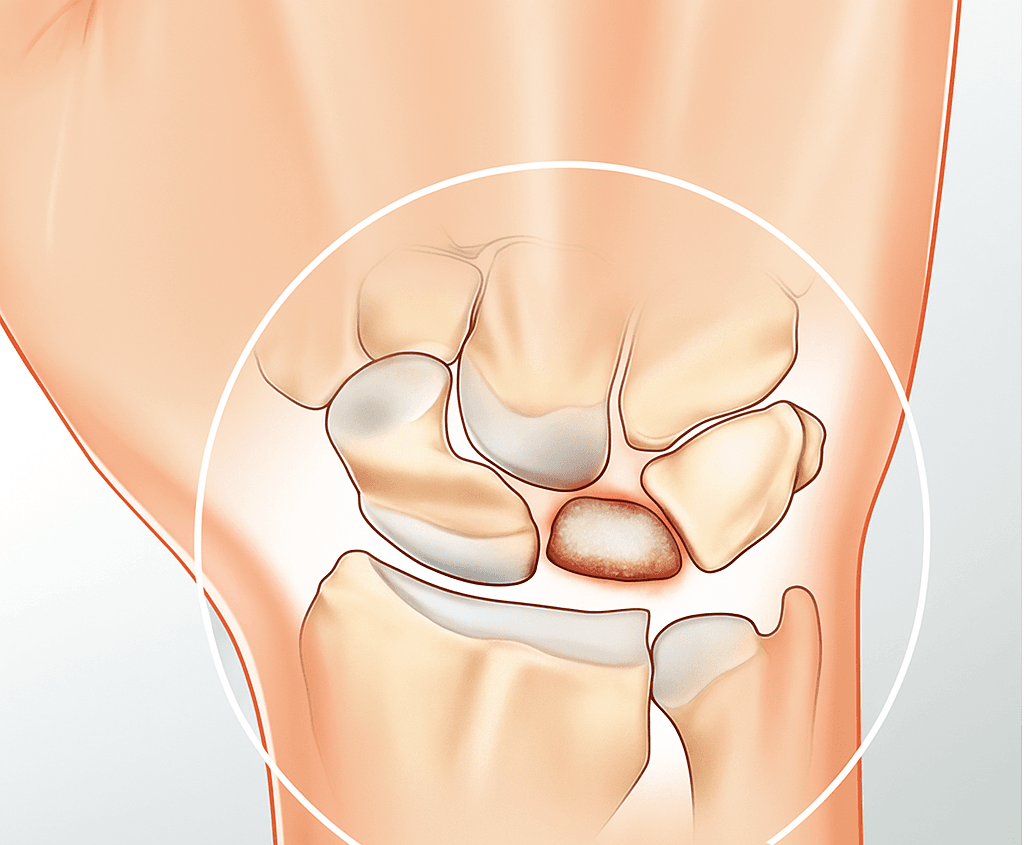
La maladie de Kienböck est une ostéonécrose idiopathique du lunatum, décrite dès 1910, qui mène progressivement à l’éboulement du cartilage et à l’arthrose carpo-métacarpienne*. Elle concerne typiquement des adultes jeunes (pic entre 20 et 40 ans) et touche davantage l’homme que la femme**. Cliniquement, le patient se plaint de douleurs de la face dorsale du poignet exacerbées à la charge, parfois d’une tuméfaction locale et d’une raideur (↓ mobilité et ↓ force de préhension)**. Le diagnostic repose sur l’imagerie : les radiographies standards (face, profil, incidence de profil brachial) classent la maladie par le système de Lichtman (stades I-IV)**. L’IRM (notamment pondérée T1) révèle l’hypointensité osseuse du lunatum et l’œdème médullaire; l’arthroscopie permet d’évaluer directement l’intégrité du cartilage et complémente le bilan diagnostique**.
Sur le plan physiopathologique, l’étiologie exacte reste débattue. On évoque une triade de facteurs : une vascularisation lunaire précaire (dépendant principalement des artérioles capsulaires) combinée à une surcharge mécanique locale**. Des études suggèrent une thrombose veineuse intra-osseuse du lunatum (syndrome des loges intraosseuses) comme mécanisme déclenchant*. Des variantes anatomiques (variance ulnaire négative, forme carrée du lunatum, orientation radiale) peuvent favoriser la charge sur le lunatum, bien qu’elles ne soient pas toujours pathogènes en soi**. Quoi qu’il en soit, l’évolution est souvent défavorable : sans décompression, l’os s’effondre progressivement, entraînant une arthrose radio‑carpienne et médio-carpienne secondaire.
Données cliniques et physiopathologiques actuelles
L’examen révèle souvent une douleur à la palpation de la tabatière anatomique et un test de pressions radiocarpiennes positif. Sur imagerie, un signe précoce est l’augmentation de densité (sclérose) du lunatum sur les radiographies*. En imagerie avancée, des séquences IRM avec contraste (DCE-MRI) peuvent objectiver une perfusion altérée du lunatum; cependant, leur utilité est désormais mieux circonscrite : un sondage auprès de chirurgiens a montré que les résultats de l’IRM de perfusion modifiaient significativement les décisions pour les stades I-II, mais restent une indication bien définie et limitée*. Plus récemment, un algorithme diagnostique propose d’abord un scanner pour évaluer l’intégrité corticale du lunatum* : si le cortex est intact (lunatum potentiellement récupérable), l’IRM de perfusion renseignera sur la viabilité; en revanche, si le lunatum est effondré (non récupérable), l’IRM n’apporte pas d’information utile pour le traitement*. Notons enfin que la classification arthroscopique (Bain) a été développée pour évaluer le nombre de surfaces articulaires fonctionnelles du lunatum, complétant les classifications classiques*.
Options thérapeutiques récentes
Traitement non opératoire
Aux stades initiaux (Lichtman I–II sans effondrement), la prise en charge débute classiquement par la protection articulaire : immobilisation en orthèse ou plâtre courte (au moins 3 mois) et arrêt des activités aggravantes*. Les études rétrospectives montrent qu’un nombre significatif de patients (en particulier les enfants, adolescents et sujets >70 ans) améliorent leurs symptômes avec un traitement conservateur seul**. Une série long-terme a même documenté une amélioration de la douleur et de la force à 5 ans malgré une progression radiologique lente*. Ainsi, en pratique, les patients jeunes ou âgés doivent d’abord bénéficier d’un traitement conservateur tant que les symptômes restent acceptables**.
Critères de choix opératoire
Le passage à la chirurgie se fait si la douleur persiste ou en cas de stade évolué. Deux critères principaux guident le choix opératoire : la variance ulnaire et l’état du cartilage du lunatum.
- Variance ulnaire : En cas de variance ulnaire négative (ulna anatomiquement plus court), le traitement de référence est l’ostéotomie radiale de raccourcissement*. Les études à long terme rapportent d’excellents résultats fonctionnels et des soulagements durables après cette intervention**. En cas de variance neutre ou positive, on privilégie soit une ostéotomie du capitatum (ou remplissage capitometacarpien)**, soit une fermeture de coin radiale (wedge osteotomy)* pour décharger le lunatum. Ces procédures modifient la répartition des contraintes au poignet sans ouvrir l’articulation principale, favorisant la décompression osseuse.
- État du cartilage lunaire : Si le lunatum est effondré mais que les surfaces articulaires adjacentes sont encore intactes (Lichtman IIIA), l’objectif est la revascularisation et l’unloading (nivelage articulaire). Par exemple, on peut combiner une ostéotomie radiale et une incision cunéiforme radiale selon Hong et al., obtenant une amélioration significative de la fonction chez la plupart des patients IIIA*. D’autres préfèrent les greffes osseuses vascularisées : la plus recommandée est la greffe pédiculée du cartilage fémoral médial (medial femoral trochlea graft)*, qui a montré une consolidation fiable chez 15/16 malades. La décompression extra‑articulaire par forage médullaire du radius (core decompression radiale ou ulnaire) constitue une autre option indirecte de revascularisation, avec de bons résultats à long terme sur la reprise d’activité**.
En revanche, si le cartilage du lunatum (ou adjacent) est déjà détruit ou si des signes d’arthrose carpo-métacarpienne apparaissent (Lichtman IIIB–IV), on oriente vers des procédures de sauvetage plus « destructrices » : arthrodèses partielles (scaphocapitale ou scapho-trapézo-trapézoïdienne) pour maintenir l’intégrité des surfaces radioscaphoïdiennes**, ou arthrodèse complète ou prothèse du poignet en dernier recours**. Par exemple, la prothèse totale de poignet peut être envisagée chez un patient actif en stade terminal pour préserver la mobilité globale*, tandis qu’une PRC (résection du rang proximal + capsuloplastie) est utile si les surfaces radio-scaphoïdiennes sont indemnes*. Une étude de cas récente a illustré la bonne efficacité fonctionnelle d’une PRC chez une femme de 41 ans en stade avancé, avec une nette diminution de la douleur post-opératoire*.
Techniques mini-invasives et innovations chirurgicales
L’arthroscopie du poignet a transformé la prise en charge en autorisant des gestes moins invasifs. Le forage arthroscopique du lunatum (core decompression) est de plus en plus pratiqué en stade précoce : cette technique permet de drainer l’hypertension veineuse intraosseuse et de soulager la douleur*. Des séries rapportent que tous les patients de stade I–II traités par forage arthroscopique retrouvent une meilleure amplitude, avec une récupération rapide grâce à l’abord mini‑invasif*. Sur le moyen terme, une étude prospective comparant 82 patients montre des résultats cliniques équivalents entre le forage arthroscopique et l’ostéotomie radiale**.
En complément, l’arthroscopie diagnostic permet d’explorer les lésions intra-articulaires (synovites typiques) et d’effectuer des débridements ou synovectomies quand nécessaire*. D’autres approches peu invasives émergent : par exemple, l’ostéotomie parincision unique ou assistée par agrafes, l’arthrolyse arthroscopique en stades avancés, etc., mais elles restent encore en cours d’évaluation clinique.
Du côté de l’imagerie, les innovations sont multiples. Les séquences IRM dynamiques ou de perfusion (CE-MRI) évaluent la vascularisation osseuse lunatum, mais leur indication doit être prudente**. D’autres outils (IRM 3T, scanner haute-résolution, micro-CT) permettent d’affiner le diagnostic et la planification chirurgicale. Enfin, l’impression 3D se développe tant pour la planification opératoire (modèles anatomiques personnalisés) que pour les implants sur mesure : un exemple spectaculaire décrit la reconstruction d’un lunatum par une greffe costale modélisée sur un implant 3D (symétrie du poignet sain), avec un résultat fonctionnel quasi normal*.
Exemples cliniques
- Cas 1 (enfant) : Garçon de 14 ans, stades I–II, variante ulnaire neutre. On opte pour une prise en charge orthopédique (immobilisation) initiale, car les patients jeunes réagissent souvent bien sans chirurgie**. Il est suivi régulièrement en imagerie.
- Cas 2 (adulte actif) : Homme 28 ans, travailleur manuel, st II, variance ulnaire négative de –2 mm. Après 6 mois de traitement conservateur inefficace, on réalise une ostéotomie radiale de raccourcissement (avec greffe pisiforme pédiculée). Cette technique assure la décompression du lunatum**. Au suivi, l’amélioration de la douleur et le maintien d’une bonne amplitude justifient l’efficacité de ce choix (conforme aux études historiques)**.
- Cas 3 (stade IIIA) : Femme 35 ans, st IIIA, lunatum affaissé mais articulation radio-scaphoïdienne préservée (cartilage globalement intact). On réalise une ostéotomie cunéenne radiale associée à une courte de la diaphyse (protocole de Hong). Cette double ostéotomie (wedge + raccourcissement) vise à « nivellement articulaire » et à décharger le lunatum*. À 2 ans, le poignet est stable et indolore.
- Cas 4 (stade avancé) : Femme 41 ans, st IIIB-IV, lunatum effondré et arthrose limitée du poignet. On choisit une PRC (résection du rang proximal + capsuloplastie). Cette solution de sauvetage améliore rapidement la douleur sans bloquer totalement le poignet. Comme le montre le rapport de cas de Jaishankar et al., la PRC a offert à cette patiente un soulagement significatif et une quasi-normalisation de la mobilité*.
Ces exemples illustrent la nécessité d’individualiser le traitement selon l’âge, le stade et la demande fonctionnelle, en suivant les algorithmes récents**.
Implications pédagogiques pour la formation des internes
La complexité de la maladie de Kienböck exige une formation spécifique. Les internes doivent maîtriser la classification radiologique et arthroscopique, savoir mesurer précisément la variance ulnaire (incidence radiologique de profil brachial) et interpréter l’IRM (séquences T1, T2, perfusion) pour évaluer la viabilité lunatum. En pratique opératoire, la formation porte sur les techniques d’arthroscopie du poignet (avec un apprentissage en simulateur ou cadavre), ainsi que sur la planification et la réalisation d’ostéotomies (radiale, capitohumérale, ulnaire).
Les nouvelles technologies pédagogiques sont encouragées. En particulier, la réalité virtuelle (VR) permet aux résidents de s’exercer à l’arthroscopie dans un environnement simulé. Des études montrent qu’un entraînement VR en arthroscopie améliore objectivement les compétences techniques des résidents par rapport à l’entraînement traditionnel**. De plus, les simulateurs VR stimulent l’intérêt des étudiants pour la chirurgie orthopédique*. Dans la même veine, l’impression 3D de modèles de poignet pathologique (basés sur IRM/CT réels) peut aider les internes à visualiser la déformation osseuse et à préparer des ostéotomies complexes. Enfin, des sessions de formation dédiées sont nécessaires pour enseigner l’utilisation des algorithmes récents (décision par CT/IRM*, classification unifiée) et la reconnaissance des échecs thérapeutiques potentiels.
Points critiques de formation : insister sur l’interprétation multidisciplinaire (orthopédie–radiologie–rhumatologie), la connaissance des règles de décision (préférence non chirurgicale chez l’enfant/vieux*, impasse de certaines techniques biologiques*), et la mise à jour face aux innovations (ex. implantation 3D-guidée). Un formateur doit également souligner les limites des études existantes (peu de comparatifs randomisés) et encourager la lecture critique des revues spécialisées (JBJS, JHS, Hand Clinics, etc.) pour rester à jour.
Conclusion
La prise en charge de la maladie de Kienböck est un domaine en pleine évolution. La stratégie thérapeutique se construit désormais sur une évaluation précise du stade et de la viabilité du lunatum : traitement conservateur prolongé pour les formes précoces ou les patients jeunes/âgés**, interventions spécifiques (nivellement articulaire, décompression, greffes) quand la symptomatologie persiste**, et enfin procédures de sauvetage (arthrodèses, arthroplasties) aux stades avancés**. Le développement de techniques mini‑invasives (arthroscopie), d’imageries fonctionnelles (IRM dynamique, CT), et même de reconstructeurs 3D sur mesure enrichit aujourd’hui l’arsenal thérapeutique**. Pour les chirurgiens en formation, maîtriser cette palette de traitements exige une pédagogie adaptée : simulation, cas cliniques illustratifs et enseignement des critères de choix doivent être intégrés dès l’internat. En synthèse, la maladie de Kienböck nécessite une approche multimodale et « à la carte », guidée par les preuves récentes et adaptée au patient, avec une formation continue pour les praticiens et stagiaires.
Bibliographie
- Lichtman DM, Pientka WF II. Kienböck Disease: Recent Advances in Understanding and Management. J Bone Joint Surg Am. 2025;107(10):e90. doi:10.2106/JBJS.24.01090**.
- Tee R, Butler S, Ek ET et al. Simplifying the Decision-Making Process in the Treatment of Kienböck’s Disease. J Wrist Surg. 2024;13(4):294–301. doi:10.1055/s-0043-1778064*.
- Camus EJ, Van Overstraeten L. Kienböck’s disease in 2021. Orthop Traumatol Surg Res. 2022;108(1S):103161. doi:10.1016/j.otsr.2021.103161**.
- Chojnowski K, Opiełka M, Piotrowicz M, et al. Recent Advances in Assessment and Treatment in Kienböck’s Disease. J Clin Med. 2022;11(3):664. doi:10.3390/jcm11030664**.
- Güvenç K, Asfuroğlu ZM, Yılmaz C, Eskandari MM. Effect of gadolinium perfusion MRI on surgeons’ management preferences in Kienböck’s disease. Hand Surg Rehabil. 2021;40(3):283–287. doi:10.1016/j.hansur.2020.12.012*.
- Zhu Z, Tang Q, Xu J, Gao Y et al. Treatment of Advanced Kienböck’s Disease Using 3D Printing–Assisted Costochondral Transplantation. JBJS Case Connect. 2022;12(4):e22.00647. doi:10.2106/JBJS.CC.22.00647**.
- Bartlett J, Khanduja V. Virtual Reality Simulator Use Stimulates Medical Students’ Interest in Orthopaedic Surgery. Arthroscopy Sports Med Rehabil. 2021;3(4):e1305–e1310. doi:10.1016/j.asmr.2021.05.014**.
- Saremi H, Shiroei S, Moradi A. Arthroscopic Treatment of Kienböck Disease: Mid-Term Outcome of Arthroscopic Lunate Core Decompression. J Hand Surg Am. 2024;49(11):1143.e1–1143.e7. doi:10.1016/j.jhsa.2023.02.011*.
- Aïm F, Lonjon G, Hannouche D, Nizard RS. Effectiveness of Virtual Reality Training in Orthopaedic Surgery: A Systematic Review. Arthroscopy. 2016;32(1):224–232. doi:10.1016/j.arthro.2015.07.023*.
- Kuhn AW, Yu JK, Gerull KM, Silverman RM, Aleem AW. Virtual Reality and Surgical Simulation Training for Orthopaedic Surgery Residents: A Qualitative Assessment of Trainee Perspectives. J Bone Joint Surg Am (Open Access). 2024;9(1):e23.00142. doi:10.2106/JBJS.OA.23.00142**.